Poniżej omówienie zadania 8 pochodzącego z arkusza maturalnego CKE - matura maj 2018, poziom rozszerzony.
Treść zadania
8. Za pomocą odpowiednio przeprowadzonych doświadczeń można porównać charakter kwasowy fenolu, kwasu solnego i kwasu węglowego.
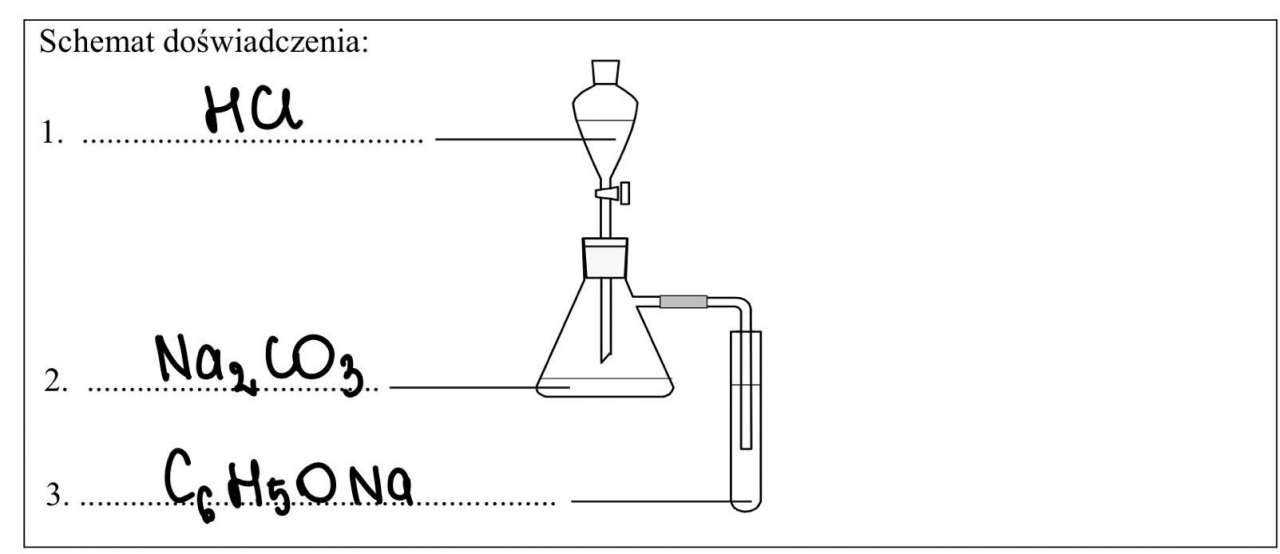
8.1. Zaprojektuj jedno doświadczenie, którym potwierdzisz, że spośród wymienionych substancji najmocniejszym kwasem jest kwas solny, a najsłabszym – fenol. W tym celu uzupełnij schemat doświadczenia. Wpisz wzory wszystkich związków, których wodnych roztworów należy użyć w doświadczeniu. Substancje wybierz spośród następujących:
> C6H5ONa
> NaCl
> HCl
> Ca(OH)2
> C6H5OH
> Na2CO3
Doświadczenie pozwalające porównać moc kwasów jakimi są: fenol, kwas węglowy oraz kwas solny będzie polegało na wypieraniu kwasu słabszego z jego soli przez kwas mocniejszy. Aby stwierdzić, który z kwasów jest kwasem najmocniejszym, a który najsłabszym, z pomocą przychodzą nam karty wzorów. Moc kwasów możemy ocenić na podstawie wartości ich stałej dysocjacji (Ka), które podane są w „Wybranych wzorach i stałych fizykochemicznych” obowiązujących do matury z chemii, biologii i fizyki dokładnie na stronie 4. Im wyższa wartość Ka tym mocniejszy kwas. Biorąc zatem pod uwagę fenol (Ka=1,3 · 10^–10), kwas węglowy (4,5 · 10^–7) i kwas chlorowodorowy (Ka=1,0 · 10^7) to właśnie HCl ma najwyższą wartość Ka i jest najmocniejszy, a najsłabszy jest fenol. Na tej podstawie możemy więc stwierdzić, że HCl powinien wyprzeć kwas węglowy z jego soli, a kwas węglowy powinien wyprzeć fenol z odpowiedniego fenolanu.
Schemat doświadczenia powinien być więc uzupełniony w następujący sposób:
- we wkraplaczu powinien znaleźć się wodny roztwór HCl
- w kolbie stożkowej – sól kwasu węglowego – z podanych substancji, tylko jedna spełnia to kryterium i jest to węglan sodu (Na2CO3)
- w probówce – fenolan sodu (C6H5ONa)
8.2. Napisz, co będzie można zaobserwować podczas przeprowadzonego doświadczenia.
Działanie kwasu solnego na wodny roztwór węglanu sodu możemy zilustrować następującą reakcją:
2HCl + Na2CO3 >>> 2NaCl + CO2 + H2O
Kwas węglowy jako nietrwały szybko ulega rozkładowi do tlenku węgla (IV) i wody. Tlenek węgla (IV) będzie wydzielał się w postaci bezbarwnych pęcherzyków gazu i w takiej postaci będzie trafiał do probówki z wodnym roztworem fenolanu sodu. W probówce dojdzie do wyparcia fenolu zgodnie z równaniem reakcji:
CO2 + H2O + C6H5ONa >>> 2 C6H5OH + Na2CO3
Fenol charakteryzuje się umiarkowaną rozpuszczalnością w wodzie. W momencie gdy dochodzi do jego wypierania można zaobserwować zmętnienie, a po pewnym czasie warstwa organiczna (fenolowa) oddziela się od warstwy wodnej. Przykładowe rozwiązanie podpunktu 8.2 można przedstawić następująco:
Kolba: wydzielają się pęcherzyki bezbarwnego gazu
Probówka: powstaje zmętnienie a po pewnym czasie rozwarstwienie cieczy
8.3 Napisz w formie jonowej skróconej równania reakcji zachodzących w kolbie i w probówce podczas przeprowadzonego doświadczenia.
W ostatnim podpunkcie zadania należy wyżej wymienione reakcje zapisane w formie cząsteczkowej przedstawić w formie jonowej skróconej:
Równanie reakcji zachodzącej w kolbie: CO3 2- + H+ >>> H2O + CO2
Równanie reakcji zachodzącej w probówce: CO2 + H2O + 2C6H5O- >>> 2 C6H5OH + CO3 2-
Autor: Joanna Włodyga